CRISPR-Cas9基因編輯技術自2012年問世至2020年獲得諾貝爾化學獎�����,僅歷時8年�,這項技術為生命科學帶來了革命性影響�。目前��,CRISPR-Cas9技術已廣泛應用于生命科學研究的諸多領域����,并且已用于地中海貧血癥臨床治療試驗�����,基因編輯技術將繼續對生命科學研究�、基因治療���、生物產業���、倫理等產生廣泛而深刻的影響�。
CRISPR-Cas9的技術原理包括向導RNA引導的Cas9靶向DNA切割和DNA修復兩個基本過程��。為了避免基因編輯技術在基因治療中產生非預期的副作用����,發展無脫靶�����、精確可控的基因編輯技術極為重要��,充分認識CRISPR-Cas9編輯介導的DNA修復結果有助于技術的發展����。之前的研究發現�,CRISPR-Cas9編輯哺乳動物細胞的DNA修復結果以插入/缺失為主�����,少量的染色體重排和堿基替代并未受到重視�����。青島能源所王士安研究員和李福利研究員帶領的分子微生物工程研究組�,在開展紅法夫酵母基因編輯研究中發現了高頻的堿基替代(點突變)修復����,并由此系統地開展了CRISPR-Cas9介導的DNA修復結果分析和機制探究�����,該項研究近日在線發表在基因編輯專業期刊The CRISPR Journal雜志上���。
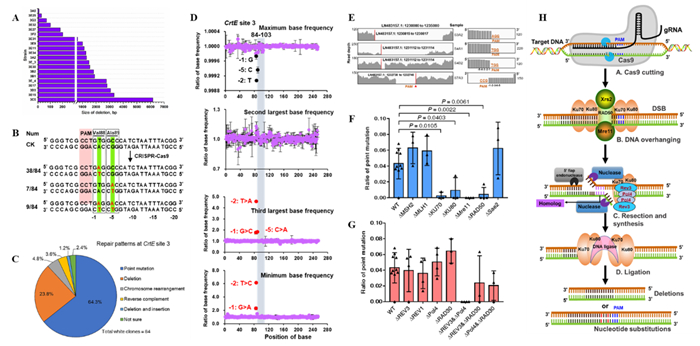
研究人員從轉化CRISPR-Cas9的102萬個紅法夫酵母轉化子中鑒定到476個自然修復克隆���,采用Sanger測序�����、Illumina測序�����、序列結構變異分析����、染色體核型分析��、遺傳突變分析和統計分析等方法����,全面分析了DNA修復類型��,并系統探究了修復產生的原因���。
研究發現����,在紅法夫酵母中CRISPR-Cas9基因編輯介導的DNA修復類型多種多樣����,包括DNA插入/缺失�、點突變���、染色體易位�����、短片段反向互補等���,并展現了多種新特征�。其中���,1 kb以上的DNA缺失并不罕見���;點突變非隨機地出現在特定靶位點��,這不同于在Hela細胞和釀酒酵母中鑒定到的少量堿基替代��;染色體易位重復性地發生在兩個DNA斷裂處���。研究還發現���,點突變和DNA缺失強烈依賴NHEJ修復途徑中的Ku70���、Ku80����、Mre11和 RAD50基因����,失活其中任何一個基因都導致DNA修復能力急劇下降�。并且��,點突變和DNA缺失還依賴非保真DNA聚合酶REV3或Pol4��,同時失活REV3和POL4基因也導致DNA修復能力明顯下降����。
盡管CRISPR-Cas9基因編輯技術已經產生了革命性影響�����,但是在基因治療領域的應用還需要更加謹慎�,目前精確基因編輯仍然難以實現�����。研究所的該項研究雖然以微生物為對象����,但是對哺乳動物細胞的基因編輯研究也具有啟發作用�����。與該研究發現具有類似性�����,人類癌癥細胞中的大量點突變由非保真DNA聚合酶產生���,并且人體細胞以NHEJ為主要的DNA修復機制�����。然而�����,以往研究并未足夠重視CRISPR-Cas9介導的人體細胞的自然DNA修復類型�,尤其是點突變���,相關研究應予以加強��,以確?;蚓庉嫾夹g在疾病治療中的安全應用�。
圖1. 紅法夫酵母中CRISPR-Cas9介導的DNA修復結果及機制��。A, DNA缺失修復�����;B, 堿基替代(點突變)修復����;C, 基因CrtE site 3位點的修復類型統計���;D, 深度測序鑒定稀有點突變���;E, 基因組測序鑒定染色體易位����;F, NHEJ途徑與CRISPR-Cas9介導的DNA修復��;G, 非保真DNA聚合酶與CRISPR-Cas9介導的DNA修復���;H, CRISPR-Cas9介導的DNA修復機制模型
研究生洪季璇���、孟子越�、張紫茜為該工作的并列第一作者�,王士安研究員和李福利研究員為通訊作者����,該工作得到了國家重點研發計劃項目和國家自然科學基金的資助����。
Jixuan Hong#, Ziyue Meng#, Zixi Zhang#, Hang Su, Yuxuan Fan, Ruilin Huang, Ruirui Ding, Ning Zhang, Fuli Li*, and Shi’an Wang*. Comprehensive analysis of CRISPR-Cas9 editing outcomes in yeast Xanthophyllomyces dendrorhous. The CRISPR Journal, 2022, 10.1089/crispr.2021.0116.